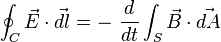martes, 24 de noviembre de 2015
ELECTROMAGNETISMO
ELECTROMAGNETISMO
El electromagnetismo es una rama de la física que estudia y unifica los fenómenos eléctricos y magnéticos en una sola teoría, cuyos fundamentos fueron sentados por Michael Faraday y formulados por primera vez de modo completo por James Clerk Maxwell. La formulación consiste en cuatro ecuaciones diferenciales vectoriales que relacionan el campo eléctrico, el campo magnético y sus respectivas fuentes materiales (corriente eléctrica, polarización eléctrica y polarización magnética),
.
jueves, 19 de noviembre de 2015
LA GALVANOSTEGÍA
La Galvanoplastia es el revestimiento de un objeto, como una llave, con una capa de metal. Se utiliza para protejer el metal que está recubierto. En este caso la llave actúa como cátodo (polo negativo) y el ánodo (polo positivo) es una pieza pura del metal revestidor (alambre de cobre). El electrolito (líquido azul) contiene sulfato de cobre disuelto en agua; cuyos iones atraviesan la solución y recubren la llave.

La Galvanoplastia es el revestimiento de un objeto, como una llave, con una capa de metal. Se utiliza para protejer el metal que está recubierto. En este caso la llave actúa como cátodo (polo negativo) y el ánodo (polo positivo) es una pieza pura del metal revestidor (alambre de cobre). El electrolito (líquido azul) contiene sulfato de cobre disuelto en agua; cuyos iones atraviesan la solución y recubren la llave.

jueves, 12 de noviembre de 2015
LEYES DE FAREDAY
LEYES DE FAREDAY
Ley de Faraday
Experimento de Faraday que muestra la inducción entre dos espiras de cable: La batería (derecha) aporta la corriente eléctrica que fluye a través de una pequeña espira (A),
creando un campo magnético. Cuando las espiras son estacionarias, no
aparece ninguna corriente inducida. Pero cuando la pequeña espira se
mueve dentro o fuera de la espira grande (B), el flujo magnético a través de la espira mayor cambia, induciéndose una corriente que es detectada por el galvanómetro (G).1
La ley de inducción electromagnética de Faraday (o simplemente ley de Faraday) establece que el voltaje inducido en un circuito cerrado es directamente proporcional a la rapidez con que cambia en el tiempo el flujo magnético que atraviesa una superficie cualquiera con el circuito como borde:2
(*)
Donde  es el campo eléctrico,
es el campo eléctrico,  es el elemento infinitesimal del contorno C,
es el elemento infinitesimal del contorno C, 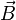 es la densidad de campo magnético y S es una superficie arbitraria, cuyo borde es C. Las direcciones del contorno C y de
es la densidad de campo magnético y S es una superficie arbitraria, cuyo borde es C. Las direcciones del contorno C y de 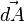 están dadas por la regla de la mano derecha.
están dadas por la regla de la mano derecha.
 es el campo eléctrico,
es el campo eléctrico,  es el elemento infinitesimal del contorno C,
es el elemento infinitesimal del contorno C, 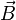 es la densidad de campo magnético y S es una superficie arbitraria, cuyo borde es C. Las direcciones del contorno C y de
es la densidad de campo magnético y S es una superficie arbitraria, cuyo borde es C. Las direcciones del contorno C y de 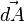 están dadas por la regla de la mano derecha.
están dadas por la regla de la mano derecha.
Esta ley fue formulada a partir de los experimentos que Michael Faraday realizó en 1831. Esta ley tiene importantes aplicaciones en la generación de electricidad.
martes, 10 de noviembre de 2015
ELECTROQUÍMICO
ELECTROQUÍMICO
Si una reacción química es provocada por una diferencia de potencial aplicada externamente, se hace referencia a una electrólisis. En cambio, si la diferencia de potencial eléctrico es creada como consecuencia de la reacción química , se conoce como un "acumulador de energía eléctrica", también llamado batería o celda galvánica.
Las reacciones químicas donde se produce una transferencia de electrones entre moléculas se conocen como reacciones redox, y su importancia en la electroquímica es vital, pues mediante este tipo de reacciones se llevan a cabo los procesos que generan electricidad o, en caso contrario, son producidos como consecuencia de ella.
En general, la electroquímica se encarga de estudiar las situaciones donde se dan reacciones de oxidación y reducción encontrándose separadas, físicamente o temporalmente, se encuentran en un entorno conectado a un circuito eléctrico. Esto último es motivo de estudio de la química analítica, en una subdisciplina conocida como análisis potenciométrico.
viernes, 6 de noviembre de 2015
EQUIVALENTE QUIMICO
EQUIVALENTE QUÍMICO
Peso equivalente, también conocido como equivalente gramo, es un término que se ha utilizado en varios contextos en química. En la mayor parte de los usos, es la masa de un equivalente, que es la masa de una sustancia dada que:- Se deposita o se libera cuando circula 1 mol de electrones
- Sustituye o reacciona con un mol de iones hidrógeno (H+) en una reacción ácido-base; o
- Sustituye o reacciona con un mol de electrones en una reacción redox.
miércoles, 4 de noviembre de 2015
LA ELECTRÓLISIS
LA ELECTROLISIS
Animación sobre la electrólisis del agua.
La electrólisis o electrolisis1 es el proceso que separa los elementos de un compuesto por medio de la electricidad. En ella ocurre la captura de electrones por los cationes en el cátodo (una reducción) y la liberación de electrones por los aniones en el ánodo (una oxidación).
Suscribirse a:
Comentarios (Atom)