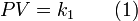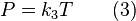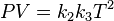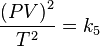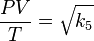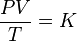miércoles, 8 de junio de 2016
SOLUCIONES MOLARES
SOLUCIONES MOLARES
Concentración Molar (M)
La concentración molar o molaridad representada por la letra M, se define como la cantidad de soluto (expresada en moles) por litro de disolución,2 o por unidad de volumen disponible de las especies:3Unidades
Las unidades SI para la concentración molar son mol/m3. Sin embargo, la mayor parte de la literatura química utiliza tradicionalmente el mol/dm3, o mol. dm-3, que es lo mismo que mol/L. Esta unidad tradicional se expresa a menudo por la M (mayúscula) (pronunciada molar), precedida a veces por un prefijo del SI, como en:Nota: es útil recordar que los términos "milimolar" (mM) y "micromolar" (μM) se refieren a 10-3 mol/L y 10-6 mol/L, respectivamente.
| Nombre | Abreviatura | Concentración |
|---|---|---|
| Milimolar | mM | 10-3 molar |
| Micromolar | μM | 10-6 molar |
| Nanomolar | nM | 10-9 molar |
| Picomolar | pM | 10-12 molar |
| Femtomolar | fM | 10-15 molar |
| Attomolar | aM | 10-18 molar |
| Zeptomolar | zM | 10-21 molar |
| Yoctomolar | yM4 | 10-24 molar (1 molécula por 1.6 litros) |
martes, 19 de abril de 2016
LEY DE LAS PRESIONES PARCIALES
LEY DE LAS PRESIONES PARCIALES
mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si sólo uno ocupase todo el volumen de la mezcla, sin variar la temperatura. La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las presiones parciales y la presión total de una mezcla.
martes, 12 de abril de 2016
LEY DE BOYLE MARIOTTE
La Ley de Boyle-Mariotte (o Ley de Boyle),
formulada por Robert Boyle y Edme Mariotte, es una de las leyes de los
gases ideales que relaciona el volumen y la presión de una cierta
cantidad de gas mantenida a temperatura constante. La ley dice que el
volumen es inversamente proporcional a la presión: 
donde  es constante si la temperatura y la masa del gas permanecen constantes.
es constante si la temperatura y la masa del gas permanecen constantes.
Cuando
aumenta la presión, el volumen disminuye, mientras que si la presión
disminuye el volumen aumenta. El valor exacto de la constante k no es
necesario conocerlo para poder hacer uso de la Ley; si consideramos las
dos situaciones de la figura, manteniendo constante la cantidad de gas y
la temperatura, deberá cumplirse la relación:
Además se obtiene despejada que:
Donde:
domingo, 20 de marzo de 2016
LEYES DE LOS GASES
Leyes de los gases
Las primeras leyes de los gases fueron desarrolladas desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables constantes.
Ley de Charles[editar]
Artículo principal: Ley de Charles
La ley de Charles, o ley de los volúmenes, fue descubierta en 1778. Se dice que, para un gas ideal a presión constante, el volumen es directamente proporcional a la temperatura absoluta (en Kelvin).
Esto se puede encontrar utilizando la teoría cinética de los gases o un recipiente con calentamiento o enfriamiento [sin congelar <0] con un volumen variable (por ejemplo, un frasco cónico con un globo).
Donde T es la temperatura absoluta del gas (en Kelvin) y k2 (en m3·K−1) es la constante producida.
Ley de Gay-Lussac[editar]
Artículo principal: Ley de Gay-Lussac
Postula que las presiones ejercidas por un gas sobre las paredes del recipiente que lo contienen son proporcionales a sus temperaturas absolutas cuando el volumen es constante.
Combinación y leyes de los gases ideales[editar]
Artículo principal: Ley general de los gases
Ley de Boyle establece que el producto presión-volumen es constante:
Ley de Charles muestra que el volumen es proporcional a temperatura absoluta:
Ley de Gay-Lussac dice que la presión es proporcional a la temperatura absoluta:
Mediante la combinación de (2) o (3) podemos obtener una nueva ecuación con P, V y T.
Definiendo el producto de K2 por K3 como K4 :
Multiplicando esta ecuación por (1):
Definiendo k5 como el producto de k1 por k4 reordenando la ecuación:
Sacando raíz cuadrada:
Renombrando la raíz cuadrada de k5 como K nos queda la ecuación general de los gases:
jueves, 3 de marzo de 2016
POSTULADOS DE LOS GASES
En
1905 Einstein aplicó la teoría cinética al movimiento browniano de una
partícula pequeña inmersa en un fluido y sus ecuaciones fueron
confirmadas por los experimentos de Perrín en 1908, convenciendo de esta
forma a los energético de la realidad de los átomos. La teoría cinética
de los gases utiliza una descripción mulecular para explicar el
comportamiento macroscópico de la materia y se basa en los siguiente
postulados:
1- Los gases están constituidos por partículas que se mueven en línea recta y al azar
2- Este movimiento se modifica si las partículas chocan entre sí o con las paredes del recipiente
3- El volumen de las partículas se considera despreciable comparado con el volumen del gas
4- Entre las partículas no existen fuerzas atractivas ni repulsivas
5- La Ec media de las partículas es porporcional a la temperatura absoluta del gas
1- Los gases están constituidos por partículas que se mueven en línea recta y al azar
2- Este movimiento se modifica si las partículas chocan entre sí o con las paredes del recipiente
3- El volumen de las partículas se considera despreciable comparado con el volumen del gas
4- Entre las partículas no existen fuerzas atractivas ni repulsivas
5- La Ec media de las partículas es porporcional a la temperatura absoluta del gas
martes, 1 de marzo de 2016
PROPIEDADES GENERALES DE LOS GASES
PROPIEDADES GENERALES DE LOS GASES
estado de agregación de la materia
en el cual, bajo ciertas condiciones de temperatura y presión, sus
moléculas interaccionan solo débilmente entre sí, sin formar enlaces
moleculares, adoptando la forma y el volumen del recipiente que las
contiene y tendiendo a separarse, esto es, expandirse, todo lo posible
por su alta energía cinética. Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad
con la presión y la temperatura. Las moléculas que constituyen un gas
casi no son atraídas unas por otras, por lo que se mueven en el vacío a
gran velocidad y muy separadas unas de otras, explicando así las
propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa.

jueves, 25 de febrero de 2016
martes, 23 de febrero de 2016
CAPAS ATMOSFERICAS
CAPAS ATMOSFERICAS
Capas de la atmósfera de la Tierra
Capas de la atmósfera.
Imagen de la estratosfera.
Troposfera
Artículo principal: Troposfera
Es la capa más cercana a la superficie terrestre, donde se desarrolla
la vida y ocurren la mayoría de los fenómenos meteorológicos. Tiene
unos 8 km de espesor en los polos
y alrededor de 16 km en el ecuador. En esta capa la temperatura
disminuye con la altura alrededor de 6,5 °C por kilómetro. La troposfera
contiene alrededor del 75 % de la masa gaseosa de la atmósfera, así
como casi todo el vapor de agua. En ella se ubica la tropopausa.Estratosfera
Artículo principal: Estratosfera
Es la capa que se encuentra entre los 10 km y los 50 km de altura.
Los gases se encuentran separados formando capas o estratos de acuerdo a
su peso. Una de ellas es la capa de ozono que protege a la Tierra del
exceso de rayos ultravioleta provenientes del Sol. Las cantidades de
oxígeno y anhídrido carbónico son casi nulas y aumenta la proporción de
hidrógeno. Actúa como regulador de la temperatura, siendo en su parte
inferior cercana a los -60 °C y aumentando con la altura hasta los 10 o
17 °C. En ella se ubica la estratopausa.Mesosfera
Artículo principal: Mesosfera
Es la capa donde la temperatura puede disminuir ( o descender) hasta
los -70 °C conforme aumenta su altitud. Se extiende desde la
estratopausa (zona de contacto entre la estratosfera y la mesosfera)
hasta una altura de unos 80 km, donde la temperatura vuelve a descender
hasta unos -80 °C o -90 °C. En ella se ubica la mesopausa.Termosfera o Ionosfera
Artículo principal: Ionosfera
Es la capa que se encuentra entre los 90 y los 400 kilómetros de altura. Su límite superior es la termopausa.
En ella existen capas formadas por átomos cargados eléctricamente,
llamados iones. Al ser una capa conductora de electricidad es la que
posibilita las transmisiones de radio y televisión
por su propiedad de reflejar las ondas electromagnéticas. El gas
predominante es el nitrógeno. Allí se produce la destrucción de los
meteoritos que llegan a la Tierra. Su temperatura aumenta desde los
-73 °C hasta llegar a 1.500 °C. En ella se ubica la ionopausa.Exosfera
Artículo principal: Exosfera
La exosfera es la capa de la atmósfera terrestre en la que los gases
poco a poco se dispersan hasta que la composición es similar a la del
espacio exterior. Es la última capa de la atmósfera, se localiza por
encima de la termosfera, aproximadamente a unos 580 km de altitud, en
contacto con el espacio exterior, donde existe prácticamente el vacío.
Es la región atmosférica más distante de la superficie terrestre. En
esta capa la temperatura no varía y el aire pierde sus cualidades
físico–químicas. En ella se ubica la exopausa.Su límite inferior se localiza a una altitud generalmente de entre 600 y 700 km, aproximadamente. Su límite con el espacio llega en promedio a los 10 000 km por lo que la exosfera está contenida en la magnetosfera (500-60 000 km), que representa el campo magnético de la Tierra. En esa región, hay un alto contenido de polvo cósmico que cae sobre la Tierra y que hace aumentar su peso en unas 20 000 toneladas.Es la zona de tránsito entre la atmósfera terrestre y el espacio interplanetario y en ella se pueden encontrar satélites meteorológicos de órbita polar. En la exosfera, el concepto popular de temperatura desaparece, ya que la densidad del aire es casi despreciable; además contiene un flujo o bien llamado plasma, que es el que desde el exterior se le ve como los Cinturones de Van Allen. Aquí es el único lugar donde los gases pueden escapar ya que la influencia de la fuerza de la gravedad no es tan grande. En la exosfera también se encuentran los satélites artificiales. Está constituida por materia plasmática. En ella la ionización de las moléculas determina que la atracción del campo magnético terrestre sea mayor que la del gravitatorio (de ahí que también se la denomina magnetosfera). Por lo tanto, las moléculas de los gases más ligeros poseen una velocidad media que les permite escapar hacia el espacio interplanetario sin que la fuerza gravitatoria de la Tierra sea suficiente para retenerlas. Los gases que así se difunden en el vacío representan una pequeñísima parte de la atmósfera terrestre.
La exosfera es la capa superior de la atmósfera terrestre. En la exosfera, una molécula puede viajar hacia arriba moviéndose lo suficientemente rápido para alcanzar la velocidad de escape, si se mueve por debajo de la velocidad de escape se le impedirá escapar del cuerpo celeste por la gravedad. Todo debido a la baja densidad de la exosfera. La exosfera es la última capa antes del espacio exterior. Dado que no existe una frontera clara entre el espacio exterior y la exosfera, la exosfera es a veces considerada una parte del espacio exterior. Composición de la Exosfera Los principales gases dentro de la exosfera son los gases más ligeros:
- Hidrógeno
- Algo de helio
- Dióxido de carbono
- Oxígeno atómico.
miércoles, 17 de febrero de 2016
ESTADO GASEOSO
ESTADO GASEOSO
al estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan solo débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta energía cinética. Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad con la presión y la temperatura. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa.
miércoles, 20 de enero de 2016
LA FUSIÒN E IMPORTANCIA
LA FUSIÒN E IMPORTANCIA
La fusión es un proceso físico que consiste en el cambio de estado de la materia del estado sólido al estado líquido por la acción del calor. Cuando se calienta un sólido, se transfiere calor a los átomos, los cuales vibran con más rapidez a medida que ganan energía.
El proceso de fusión de la materia es el mismo que el de fundición, pero este último término se aplica generalmente a sustancias como los metales, que se licúan a altas temperaturas, y a sólidos cristalinos. Cuando una sustancia se encuentra a su temperatura de fusión, el calor que se suministra es absorbido por la sustancia durante su transformación, y no produce variación de su temperatura. Este calor adicional se conoce como calor de fusión. El término fusión se aplica también al proceso de calentar una mezcla de sólidos para obtener una disolución líquida simple.
Tabla con los puntos de fusión de algunas sustancias
| Cuerpos puros | Temperatura de fusión / solidificación (°C) | Temperatura de ebullición (°C) |
|---|---|---|
| H2O | 0 °C | 100 °C |
| Ciclohexano | 6 °C | 81 °C |
| Mercurio | -39 °C | 357 °C |
| Hierro | 1538 °C | 2862 °C |
| Oxígeno | -218 ºC | -183 ºC |
| Etanol | -114 ºC | 78,37 ºC |
miércoles, 13 de enero de 2016
LEYES DE LA TERMODINÀMICA
LEYES DE LA TERMODINÀMICA
Primera Ley de la Termodinamica
Esta ley se expresa como:Notar que el signo menos en el lado derecho de la ecuación se debe justamente a que W se define como el trabajo efectuado por el sistema.
Para entender esta ley, es útil imaginar un gas encerrado en un cilindro, una de cuyas tapas es un émbolo móvil y que mediante un mechero podemos agregarle calor. El cambio en la energía interna del gas estará dado por la diferencia entre el calor agregado y el trabajo que el gas hace al levantar el émbolo contra la presión atmosférica
Segunda Ley de la Termodinamica
La primera ley nos dice que la energía se conserva. Sin embargo, podemos imaginar muchos procesos en que se conserve la energía, pero que realmente no ocurren en la naturaleza. Si se acerca un objeto caliente a uno frío, el calor pasa del caliente al frío y nunca al revés. Si pensamos que puede ser al revés, se seguiría conservando la energía y se cumpliría la primera ley.En la naturaleza hay procesos que suceden, pero cuyos procesos inversos no. Para explicar esta falta de reversibilidad se formuló la segunda ley de la termodinamica, que tiene dos enunciados equivalentes:
Enunciado de Kelvin - Planck : Es imposible construir una máquina térmica que, operando en un ciclo, no produzca otro efecto que la absorción de energía desde un depósito y la realización de una cantidad igual de trabajo.
viernes, 8 de enero de 2016
TERMODINÀMICA
TERMODINÀMICA
definidos como aquel estado hacia «el que todo sistema tiende a
evolucionar y caracterizado porque en el mismo todas las propiedades del
sistema quedan determinadas por factores intrínsecos y no por
influencias externas previamente aplicadas».
Tales estados terminales de equilibrio son, por definición,
independientes del tiempo, y todo el aparato formal de la termodinámica
–todas las leyes y variables termodinámicas– se definen de tal modo que
podría decirse que un sistema está en equilibrio si sus propiedades
pueden describirse consistentemente empleando la teoría termodinámica.
Los estados de equilibrio son necesariamente coherentes con los
contornos del sistema y las restricciones a las que esté sometido. Por
medio de los cambios producidos en estas restricciones (esto es, al
retirar limitaciones tales como impedir la expansión del volumen del
sistema, impedir el flujo de calor, etc.), el sistema tenderá a
evolucionar de un estado de equilibrio a otro;9
comparando ambos estados de equilibrio, la termodinámica permite
estudiar los procesos de intercambio de masa y energía térmica entre
sistemas térmicos diferente
Suscribirse a:
Comentarios (Atom)