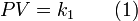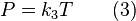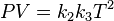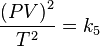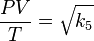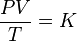domingo, 20 de marzo de 2016
LEYES DE LOS GASES
Leyes de los gases
Las primeras leyes de los gases fueron desarrolladas desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables constantes.
Ley de Charles[editar]
Artículo principal: Ley de Charles
La ley de Charles, o ley de los volúmenes, fue descubierta en 1778. Se dice que, para un gas ideal a presión constante, el volumen es directamente proporcional a la temperatura absoluta (en Kelvin).
Esto se puede encontrar utilizando la teoría cinética de los gases o un recipiente con calentamiento o enfriamiento [sin congelar <0] con un volumen variable (por ejemplo, un frasco cónico con un globo).
Donde T es la temperatura absoluta del gas (en Kelvin) y k2 (en m3·K−1) es la constante producida.
Ley de Gay-Lussac[editar]
Artículo principal: Ley de Gay-Lussac
Postula que las presiones ejercidas por un gas sobre las paredes del recipiente que lo contienen son proporcionales a sus temperaturas absolutas cuando el volumen es constante.
Combinación y leyes de los gases ideales[editar]
Artículo principal: Ley general de los gases
Ley de Boyle establece que el producto presión-volumen es constante:
Ley de Charles muestra que el volumen es proporcional a temperatura absoluta:
Ley de Gay-Lussac dice que la presión es proporcional a la temperatura absoluta:
Mediante la combinación de (2) o (3) podemos obtener una nueva ecuación con P, V y T.
Definiendo el producto de K2 por K3 como K4 :
Multiplicando esta ecuación por (1):
Definiendo k5 como el producto de k1 por k4 reordenando la ecuación:
Sacando raíz cuadrada:
Renombrando la raíz cuadrada de k5 como K nos queda la ecuación general de los gases:
jueves, 3 de marzo de 2016
POSTULADOS DE LOS GASES
En
1905 Einstein aplicó la teoría cinética al movimiento browniano de una
partícula pequeña inmersa en un fluido y sus ecuaciones fueron
confirmadas por los experimentos de Perrín en 1908, convenciendo de esta
forma a los energético de la realidad de los átomos. La teoría cinética
de los gases utiliza una descripción mulecular para explicar el
comportamiento macroscópico de la materia y se basa en los siguiente
postulados:
1- Los gases están constituidos por partículas que se mueven en línea recta y al azar
2- Este movimiento se modifica si las partículas chocan entre sí o con las paredes del recipiente
3- El volumen de las partículas se considera despreciable comparado con el volumen del gas
4- Entre las partículas no existen fuerzas atractivas ni repulsivas
5- La Ec media de las partículas es porporcional a la temperatura absoluta del gas
1- Los gases están constituidos por partículas que se mueven en línea recta y al azar
2- Este movimiento se modifica si las partículas chocan entre sí o con las paredes del recipiente
3- El volumen de las partículas se considera despreciable comparado con el volumen del gas
4- Entre las partículas no existen fuerzas atractivas ni repulsivas
5- La Ec media de las partículas es porporcional a la temperatura absoluta del gas
martes, 1 de marzo de 2016
PROPIEDADES GENERALES DE LOS GASES
PROPIEDADES GENERALES DE LOS GASES
estado de agregación de la materia
en el cual, bajo ciertas condiciones de temperatura y presión, sus
moléculas interaccionan solo débilmente entre sí, sin formar enlaces
moleculares, adoptando la forma y el volumen del recipiente que las
contiene y tendiendo a separarse, esto es, expandirse, todo lo posible
por su alta energía cinética. Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad
con la presión y la temperatura. Las moléculas que constituyen un gas
casi no son atraídas unas por otras, por lo que se mueven en el vacío a
gran velocidad y muy separadas unas de otras, explicando así las
propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa.

Suscribirse a:
Entradas (Atom)